🌐 Lien de l’article
✒️ Auteur de l’article
Les chercheurs découvrent une voie inattendue vers de meilleures batteries lithium-soufre en visualisant les réactions à l’échelle atomique.
Le parcours depuis une découverte en laboratoire jusqu’à une application dans le monde réel peut être long et semé d’embûches. Prenez par exemple la batterie lithium-soufre. Bien qu’elle présente des avantages significatifs par rapport aux batteries lithium-ion existantes utilisées dans les véhicules, elle n’a toujours pas fait sa marque sur le marché malgré des années de développement rigoureux.
Cette situation pourrait changer à l’avenir grâce aux efforts des scientifiques du ministère américain de l’Énergie (BICHE) Laboratoire National d’Argonne. Au cours de la dernière décennie, ils ont réalisé plusieurs découvertes cruciales liées aux batteries lithium-soufre. Leur dernière révélation, publiée dans Nature, révèle un mécanisme de réaction jusqu’alors inconnu qui répond à une lacune majeure : la durée de vie très courte des batteries.
Gui-Liang Xu, chimiste à la division des sciences chimiques et de l’ingénierie d’Argonne, a déclaré « Les efforts de notre équipe pourraient rapprocher les États-Unis d’un paysage de transport plus vert et plus durable.
Les batteries lithium-soufre offrent trois avantages significatifs par rapport aux batteries lithium-ion actuelles. Premièrement, ils peuvent stocker deux à trois fois plus d’énergie dans un volume donné, ce qui permet d’allonger l’autonomie des véhicules. Deuxièmement, leur moindre coût, facilité par l’abondance et le prix abordable du soufre, les rend économiquement viables. Enfin, ces batteries ne dépendent pas de ressources critiques comme le cobalt et le nickel, qui pourraient être confrontées à des pénuries à l’avenir.
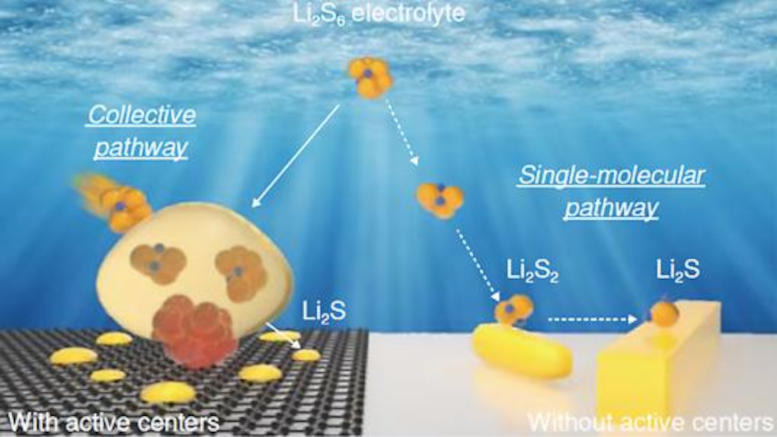
Différentes voies de réaction du polysulfure de lithium (Li₂S₆) au sulfure de lithium (Li₂S) dans les batteries lithium-soufre avec (à gauche) et sans (à droite) catalyseur dans la cathode de soufre. Crédit : Laboratoire National d’Argonne
Malgré ces avantages, la transition du succès en laboratoire à la viabilité commerciale s’est révélée difficile à réaliser. Les cellules de laboratoire ont montré des résultats prometteurs, mais lorsqu’elles sont mises à l’échelle commerciale, leurs performances diminuent rapidement avec des charges et décharges répétées.
La cause sous-jacente de cette baisse de performance réside dans la dissolution du soufre de la cathode lors de la décharge, conduisant à la formation de polysulfures de lithium solubles (Li2S6). Ces composés s’écoulent dans l’électrode négative (anode) au lithium métallique pendant la charge, aggravant encore le problème. Par conséquent, la perte de soufre de la cathode et les modifications de la composition de l’anode nuisent considérablement aux performances de la batterie pendant le cyclage.
Dans une étude récente, les scientifiques d’Argonne ont développé un matériau catalytique qui, ajouté en petite quantité à la cathode de soufre, éliminait essentiellement le problème de perte de soufre. Bien que ce catalyseur se soit montré prometteur dans les cellules de laboratoire et de taille commerciale, son mécanisme de fonctionnement à l’échelle atomique est resté jusqu’à présent une énigme.
Les recherches les plus récentes de l’équipe ont mis en lumière ce mécanisme. En l’absence de catalyseur, des polysulfures de lithium se forment à la surface de la cathode et subissent une série de réactions, convertissant finalement la cathode en sulfure de lithium (Li2S).
« Mais la présence d’une petite quantité de catalyseur dans la cathode fait toute la différence », a déclaré Xu.« S’ensuit une voie réactionnelle très différente, sans étapes réactionnelles intermédiaires.
La clé est la formation de denses à l’échelle nanométrique des bulles de polysulfures de lithium à la surface de la cathode, qui n’apparaissent pas sans le catalyseur. Ces polysulfures de lithium se propagent rapidement dans toute la structure cathodique pendant la décharge et se transforment en sulfure de lithium constitué de cristallites à l’échelle nanométrique. Ce processus évite la perte de soufre et la baisse de performance dans les cellules de taille commerciale.
En déverrouillant cette boîte noire autour du mécanisme réactionnel, les scientifiques ont eu recours à des techniques de caractérisation de pointe. Analyses de la structure du catalyseur avec les faisceaux intenses de rayons X synchrotron sur la ligne de lumière 20-BM de la source de photons avancée, un BICHE L’installation utilisateur de l’Office of Science a révélé qu’elle joue un rôle essentiel dans le processus de réaction. La structure du catalyseur affecte la forme et la composition du produit final lors de la décharge, ainsi que les produits intermédiaires. Avec le catalyseur, du sulfure de lithium nanocristallin se forme lors d’une décharge complète. Sans le catalyseur, des structures microscopiques en forme de bâtonnet se forment.
Une autre technique vitale, développée à l’Université de Xiamen, a permis à l’équipe de visualiser l’interface électrode-électrolyte à l’échelle nanométrique pendant qu’une cellule de test fonctionnait. Cette technique nouvellement inventée a permis de relier les changements à l’échelle nanométrique au comportement d’une cellule en fonctionnement.
« Sur la base de notre découverte passionnante, nous effectuerons davantage de recherches pour concevoir des cathodes au soufre encore meilleures », a noté Xu. « Il serait également intéressant d’explorer si ce mécanisme s’applique à d’autres batteries de nouvelle génération, comme celles au sodium-soufre. »
Grâce à cette dernière avancée de l’équipe, l’avenir des batteries lithium-soufre semble plus prometteur, offrant une solution plus durable et plus respectueuse de l’environnement pour l’industrie des transports.
Outre Xu, les auteurs incluent Shiyuan Zhou, Jie Shi, Sangui Liu, Gen Li, Fei Pei, Youhu Chen, Junxian Deng, Qizheng Zheng, Jiayi Li, Chen Zhao, Inhui Hwang, Cheng-Jun Sun, Yuzi Liu, Yu Deng. , Ling Huang, Yu Qiao, Jian-Feng Chen, Khalil Amine, Shi-Gang Sun et Hong-Gang Liao.
Les autres institutions participantes comprennent l’Université de Xiamen, l’Université de technologie chimique de Pékin et l’Université de Nanjing. La recherche sur Argonne a été soutenue par l’Office of Vehicle Technologies du DOE de l’Office of Energy Efficiency and Renewable Energy.
Cette recherche a utilisé les ressources de Advanced Photon Source, une installation utilisateur du Bureau des sciences du DOE des États-Unis, exploitée pour le Bureau des sciences du DOE par le Laboratoire national d’Argonne sous le contrat n° DE-AC02-06CH11357.